紫外吸收光谱的基本原理
吸收光谱的产生
许多无色透明的有机化合物,虽不吸收可见光,但往往能吸收紫外光。如果用一束具有连续波长的紫外光照射有机化合物,这时紫外光中某些波长的光辐射就可以被该化合物的分子所吸收,若将不同波长的吸收光度记录下来,就可获的该化合物的紫外吸收光谱.
紫外光谱的表示方法
通常以波长λ为横轴、吸光度A(百分透光率T%)为纵轴作图,就可获的该化合物的紫外吸收光谱图。
吸光度A,表示单色光通过某一样品时被吸收的程度 A=log(I0/I1), I0入射光强度,I1透过光强度;
透光率也称透射率T,为透过光强度I1与入射光强度I0之比值,T= I1/I0透光率T与吸光度A的关系为 A=log(1/T)
根据朗伯-比尔定律,吸光度A与溶液浓度c成正比 A=εbc ε为摩尔吸光系数,它是浓度为1mol/L的 溶液在1cm的吸收池中,在一定波长下测得的吸光度,它表示物质对光能的吸收强度,是各种物质在一定波长下的特征常数,因而是检定化合物的重要数据;c为物质的浓度,单位为mol/L;b为液层厚度,单位为cm。
在紫外吸收光谱中常以吸收带最大吸收处波长λmax和该波长下的摩尔吸收系数εmax来表征化合物吸收特征。吸收光谱反映了物质分子对不同波长紫外光的吸收能力。吸收带的形状、λmax和εmax与吸光分子的结构有密切的关系。各种有机化合物的λmax和εmax都有定值,同类化合物的εmax比较接近,处于一个范围。
紫外吸收光谱是由分子中价电子能级跃迁所产生的。由于电子能级跃迁往往要引起分子中核的运动状态的变化,因此在电子跃迁的同时,总是伴随着分子的振动能级和转动能级的跃迁。考虑跃迁前的基态分子并不是全是处于最低振动和转动能级,而是分布在若干不同的振动和转动能级上;而且电子跃迁后的分子也不全处于激发态的最低振动和转动能级,而是可达到较高的振动和转动能级,因此电子能级跃迁所产生的吸收线由于附加上振动能级和转动能级的跃迁而变成宽的吸收带。此外,进行紫外光谱测定时,大多数采用液体或溶液试样。液体中较强的分子间作用力,或溶液中的溶剂化作用都导致振动、转动精细结构的消失。但是在一定的条件下,如非极性溶剂的稀溶液或气体状态,仍可观察到紫外吸收光谱的振动及转动精细结构。
分子轨道与电子跃迁的类型
分子轨道基本原理
根据分子轨道理论,当2个原子形成化学键时,原子轨道将进行线性组合形成分子轨道。分子轨道具有分子的整体性,它将2个原子作为整体联系在一起,形成的分子轨道数等于所组合的原子轨道数。例如两个外层只有1个S电子的原子结合成分子时,两个原子轨道可以线性组合形成两个分子轨道,其中一个分子轨道的能量比相应的原子轨道能量低,称为成键分子轨道;另一个分子轨道的能量比相应的原子轨道能量高,称为反键分子轨道(反键轨道常用*标出)。
分子轨道中最常见的有σ轨道和π轨道两类。σ轨道是原子外层的S轨道与S轨道、或Px轨道与Px轨道(沿χ轴靠近时)线性组合形成的分子轨道。成键σ分子轨道的电子云分呈圆柱型对称,电子云密集于两原子核之间;而反键σ分子轨道的电子云在原子核之间的分布比较稀疏,处于成键σ轨道上的电子称为成键σ电子,处于反键σ轨道上的电子称为反键σ电子。π轨道是原子最外层Py轨道或Pz轨道(沿χ轴靠近时)线性组合形成的分子轨道。成键π分子轨道的电子云分不呈圆柱型对称,但有一对对称,在此平面上电子云密度等于零,而对称面的上下部空间则是电子云分布的主要区域。反键π分子轨道的电子云也有一对称面,但2个原子的电子云互相分离,处于成键π轨道的电子称为成键π电子,处于反键π轨道的电子称为反键π电子。
含有氧、氮、硫等原子的有机化合物分子中,还存在未参与成键的电子对,常称为孤对电子。孤对电子是非键电子,也称为n电子。例如甲醇分子中的氧原子,其外层有6个电子,其中2个电子分别与碳原子和氢原子形成2个σ键其余4个电子并未参与成键,仍处于原子轨道上,称为n电子。而n电子的原子轨道称为n轨道。
电子跃迁的类型
根据分子轨道的计算结果,分子轨道能级的能量以反键σ轨道最高,而n轨道的能量介于成键轨道与反键轨道之间。分子轨道能级的高低次序如下:
σ*>π*>n>π>σ
电子跃迁方式主要有4种如图1所示
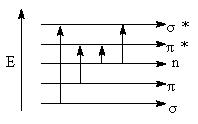
图1σ、π、n轨道及电子跃迁
1、σ σ* σ键键能高,要使σ电子跃迁需要很高的能量,大约780KJ.mol-1,是一种高能跃迁。这类跃迁对应的吸收波长都在真空紫外区,在近紫外区是透明的,所以常用作测定紫外吸收光谱的溶剂。
2、 n σ* 分子中含有氧、氮、硫、卤素等原子,则产生这种跃迁,它比σ σ* 跃迁的能量低得多。(甲硫醇 227nm,碘甲烷258nm)
3、π π* 不饱和化合物及芳香化合物除含σ电子外,还含有π电子。π电子容易受激发,电子从成键的π轨道跃迁到反键的π轨道所需的能量比较低。一般孤立双键的乙烯、丙烯等化合物,其π π* 跃迁的波长在170-200nm范围内,但吸收强度强(104)。如果烯烃上有取代基或烯键与其它双键共轭,π π*跃迁的吸收波长将红移到近紫外区。芳香族化合物存在环状的共轭体系,π π* 跃迁会出现三个吸收带即E吸收带、K吸收带、B吸收带(苯:184nm、203nm、256nm)。
4、 n π* 当化合物分子中同时含有π电子和n电子则可产生这种跃迁,n π* ,所需的能量最低,其所产生的吸收波长最长,但吸收强度很弱(丙酮:280nm,15)。
电子跃迁类型与分子结构及其存在的基团有密切的关系,可以根据分子结构来预测可能的电子跃迁(饱和烃 σ σ* ,烯烃 σ σ*、π π*, 脂肪醚σ σ*、n σ*,醛酮 π π* 、 n σ* 、
σ σ* 、 n π*)。
发色基团、助色基团和吸收带
(1)发色基团和助色基团
发色基团 能使化合物出现颜色的一些基团。在紫外吸收光谱中沿用这一术语,其含义已经扩充到凡是能导致化合物在紫外及可见光区产生吸收的基团,不论是否显示颜色都称为发色基团。一般不饱和的基团都是发色基团(C=C、C=O、N=N 、三键、苯环等)。
如果化合物中有几个发色基团相互共轭,则各个发色基团所产生的吸收带将消失,而取代出现新的共轭吸收带,其波长将比单个发色基团的吸收波长长,吸收强度也显著加强。
助色基团 早期引入的一个术语,它是指那些本身不会使化合物分子产生颜色或者在紫外及可见光区不产生吸收的一些基团,但这些基团与发色基团相连时却能使发色基团的吸收带波长移向长波,同时使吸收强度增加。通常,助色基团是由含有孤对电子的元素所组成(-NH2 , -NR2 , -OH , -OR , -Cl等),这些基团借助P-π共轭使发色基团增加共轭程度,从而使电子跃迁的能量下降。
各种助色基团的助色效应各不相同,以O- 为最大,F为最小。助色基团的助色效应强弱大致如下列顺序。
F < CH3 <Cl < Br < OH < SH < OCH3 <NH2 <NHR < NR2 < O-
(二)红移、蓝移、增色效应和减色效应
由于有机化合物分子中引入了助色基团或其他发色基团而产生结构的改变,或者由于溶剂的影响使其紫外吸收带的最大吸收波长向长波方向移动的现象称为红移。与此相反,如果吸收带的最大吸收波长向短波方向移动,则称为蓝移。
与吸收带波长红移及蓝移相似,由于化合物分子结构中引入取代基或受溶剂的影响,使吸收带的强度即摩尔吸光系数增大或减少的想象称为增色效应或减色效应。
(三) 吸收带
在四种电子跃迁类型中,σ σ*跃迁和n σ*跃迁上产生的吸收带波长处于真空紫外区。π π*跃迁和n π*跃迁所产生的吸收带除某些孤立双键化合物外,一般都处于近紫外区,它们是紫外吸收光谱所研究的主要吸收带 。
由π π* 跃迁和n π*跃迁所产生的吸收带可分为下述四种类型
1、R吸收带 由含有氧、硫、氮等杂原子的发色基团(羰基、硝基)n π*跃迁所产生, 吸收波长长,吸收强度低(乙醛 290nm,17)。
2、 K吸收带 由含有共轭双键(丁二烯、丙烯醛)的π π*跃迁所产生,K吸收带波长大于200nm,吸收强度强(104)。
3、 B吸收带 是闭合环状共轭双键的π π*跃迁所产生的,是芳环化合物的主要特征吸收峰。吸收波长长,吸收强度低(苯 256nm,215)。在非极性溶剂中或气态时,B吸收大带会出现精细结构,但有一些芳香化合物的B吸收带往往没有精细结构,极性溶剂的使用会使精细结构消失。
4、 E吸收带 芳香化合物的特征吸收带,有两个吸收峰,分别为E1带和E2带,E1的吸收约在180nm(ε>104),E2的吸收约在200nm(ε=7000),都是强吸收,E1的吸收带是观察不到的,当苯环上有发色基团且与苯环共轭时,E2的吸收带常和K吸收带合并,吸收峰向长波移动(苯乙酮,K 240nm,13000;B 278nm,1100;R 319nm ,59)
共轭体系与吸收带波长的关系
只含孤立双键的化合物如乙烯,其π π*跃迁的吸收波长处于真空紫外区。如果有两个或多个双键共轭,则π π*跃迁的吸收波长随共轭程度增加而增加,这种现象称为共轭红移。表1列出了一些共轭烯烃的吸收光谱特征。从表中可以看出每增加一个共轭双键,吸收波长约增加40nm当双键数达到7时,吸收波长将进入可见光区。
| 化合物 | π π*跃迁(λ/nm) | 摩尔吸光系数 |
| 乙烯 1,3-丁二烯 1,3,5-己三烯 二甲基辛四烯 癸五烯 | 170 217 256 296 335 | 1.5×104 2.1×104 3.5×104 5.2×104 11.8×104 |
表1 某些共轭烯烃的吸收特征
不同的发色基团共轭也会引起π π*跃迁吸收波长红移。如果共轭基团中还含有n电子,则n π*跃迁吸收波长也会引起红移(乙醛π π*,170nm n π*,290nm;丙烯醛分子中由于存在双键与羰基共轭,π π*,210nm,n π*,315nm)。
共轭使吸收带波长红移,可以认为是由于共轭形成了包括共轭碳原子之间的离域π键,π电子更容易被激发而跃迁到反键π轨道上。例如丁二烯分子中每个碳原子的Pz电子可以组成四个非定域分子轨道,即两个成键π轨道π1、π2和两个反键π轨道π3*、π4*,如图2所示。当丁二烯分子受到紫外光激发时,处于π2轨道上的电子只需接受较低的能量就可以跃迁到π3*轨道上,这就导致吸收带波长红移。
羰基与烯双键共轭不但使电子在成键π轨道与反键π轨道之间跃迁的能量降低,也使n π*跃迁的能量降低,如图4所示。非共轭双键不会影响吸收带的波长,但对吸收带强度有增色效应。
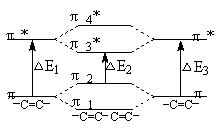
图2 共轭双键能级图
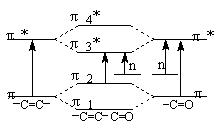
图3 羰基与烯双键共轭能级图

